글로벌 임상 3상은 상업화로 가기 위한 첫 걸음일 뿐
"캄렐리주맙+리보세라닙 병용요법 차별성과 경쟁력은
의료 학회서 공개되는 데이터 통해 정확히 판단 가능"
중국 바이오파마는 강력한 내수 시장을 기반으로 다양한 me-too drugs를 개발하다가 수년 전부터 fast-follower 혹은 first in class를 표방하는 약물 개발에도 뛰어들었다. 중국 내 바이오텍이 매우 빠른 속도로 증가함에 따라 내수 시장을 공략하는 것만으로는 명확한 한계가 생겼기 때문이다. 더불어 이러한 양상은 항체 기반의 모달리티와 세포 치료제 영역에서 두드러진다.
따라서 중국 회사들에게도 글로벌 진출은 중요한 목표가 되었고 이를 효과적으로 구현하기 위해 미국 등에 연구 혹은 개발 중심 자회사를 만드는 일이 빈번해졌다. 중국의 대표적인 파마인 항서제약도 그 중 하나다.
최근 항서제약은 미국에 개발 중심 자회사, Luzsana를 설립했고 빅파마에서 개발 경험이 풍부한 인력들로 구성했다. 항서제약에서 개발 중인 후보물질 중, 글로벌 상업화 가능성이 높은 것을 중심으로 개발할 계획이다. 공개된 주요 파이프라인1 을 보면, ADC(HER2, HER3, Trop2, CLDN18.2)가 많고 AR inhibitor(SHR-3680), PARP inhibitor(SHR-3162)도 눈에 띈다. 여러 파이프라인 중, 가장 개발 속도가 빠른 것은 간세포암 1차 치료제 관련 항PD-1항체 캄렐리주맙(camrelizumab)과 에이치엘비의 리보세라닙 병용요법 글로벌 임상 3상이다.
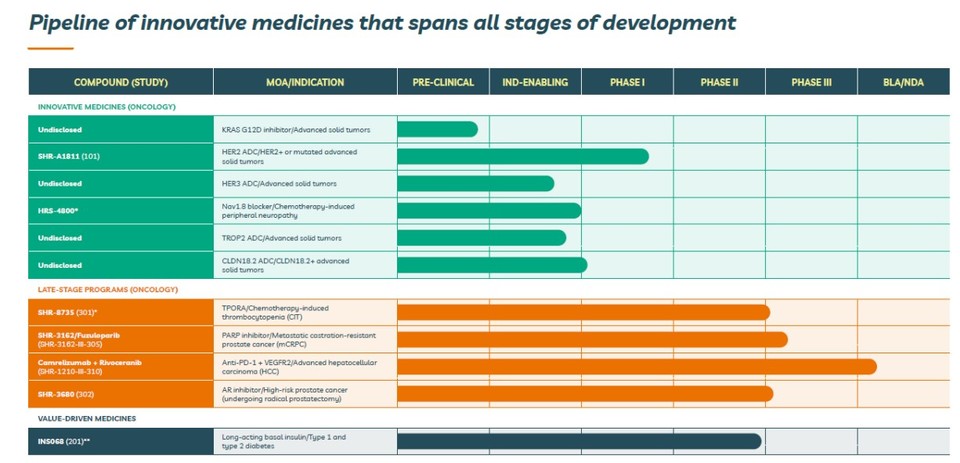
최근 항서제약과 에이치엘비는 간세포암 1차 치료제 임상 관련 탑라인 결과를 발표했다. 공동 1차 유효성 평가 지표(무진행생존기간, 전체생존기간)를 만족했고 통계적 유의성도 확보했다고 전했다. 더불어 항서제약은 이미 중국 NMPA에 신약허가신청을 하였고 미국 FDA에 BLA 신청을 위한 소통에도 돌입했다고 한다2 . 간세포암 1차 치료제 임상 탑라인 발표 시점과 개발 중심 미국 자회사 Luzsana의 론칭 소식이 비슷한 시점에 발표된 점은 흥미로운 부분이다. 또한 Luzsana는 미국 시장 진출을 위한 첫 번째 타깃으로 간세포암 1차 치료제 관련 캄렐리주맙+리보세라닙 병용요법으로 설정했다.
최근 일부 중국 회사(e.g. Innovent, Junshi)가 중국에서만 진행된 임상 데이터를 근거로 항PD-1항체의 미국 진출을 모색했었다. 하지만 FDA는 여러가지 이유로 반려했고 상용화 된 항PD-(L)1 항체의 절반 이상이 중국산임에도 이들의 미국 시장 진출은 아직 이뤄지지 못했다. 이런 상황에서 항서제약은 항PD-1항체 단독요법이 아닌, 혈관신생저해제 리보세라닙과의 병용요법으로 간세포암 1차 치료제 관련 글로벌 3상을 진행했다. 해당 임상시험에는 미국 임상 사이트도 일부 존재하기 때문에 FDA가 내세운 거부 사유는 상당 부분 해결한 셈이다.
그렇다면, 캄렐리주맙+리보세라닙 병용요법은 간세포암 1차 치료라인에서 어떠한 경쟁력과 차별성이 있을까? 지금은 명확히 알 수 없다. 구체적인 데이터는 추후 학회에서 발표할 예정이기 때문에 전체 데이터가 나온 후에 판단하는 것이 적절할 것이다. 다만, 이 계열에는 유사한 기전의 병용요법 조합이 2020년 5월에 FDA 승인을 받았다. 우리에게 익숙한 항PD-L1항체 아테졸리주맙과 항혈관신생항체 베바시주맙 병용요법이다. 해당 병용요법 연구 결과는 2020년 NEJM에 발표1 되었고 2021년 AACR에서는 risk status에 따른 하위 그룹 데이터도 업데이트 하였다.

후발 주자로 시장에 진입하는 약물이라면, NCCN Guidelines에 ‘preferred regimens’로 등재된 아테졸리주맙+베바시주맙 병용요법 대비 차별화된 프로파일이 필요할 것이다. 여기서 차별화된 프로파일이라는 것은 단순히 1차 유효성 평가지표만을 의미하는 것은 아니다. 간세포암의 특성상, 다양한 하위 그룹이 존재하고 글로벌 임상 3상을 수행한 여러 그룹들의 환자군을 보더라도 꽤 이질성이 있기 때문이다. 다만, 우리는 몇 개의 임상 3상 연구를 통해 면역관문억제제와 혈관신생저해제 병용 투여가 기존 표준 치료제인 소라페닙 대비 유의한 생존 혜택이 있다는 것은 알 수 있었다.

그리고 이러한 병용요법은 간세포암의 발병과 관련된 바이러스 병인 측면에서 B형 간염 바이러스(HBV)와 연관된 간세포암 환자에서 좀 더 두드러진 생존 혜택을 보여줬다. 반면에 C형 간염 바이러스(HCV)와 연관된 간세포암 환자 혹은 바이러스와 무관한 비알코올성 지방간염(NASH) 혹은 알콜성 지방간염(ASH)과 연관된 환자는 무진행 생존기간의 혜택을 일부 보여주긴 했지만, 전체 생존기간의 혜택은 미미했다(COSMIC-312 trial)2 .
이를 근거로 면역관문억제제와 혈관신생저해제와 병용요법이 HBV 타입에 좀 더 효과적이라고 단정할 순 없다. 하지만, IMbrave150(아테졸리주맙+베바시주맙) 연구에서 HBV와 HCV의 비율은 49% vs 21%였고 COSMIC-312 연구(아테졸리주맙+카보잔티닙)에서 29% vs 31%였다는 점은 주목할 만한 대목이다. 즉, 엇갈린 최종 결과를 보였던 두 연구의 바이러스 병인(viral etiology)는 꽤 이질성이 있었던 것이다. 또한 몇 개의 임상 3상에 모집된 환자군 프로파일은 바이러스 병인 뿐만 아니라, 다른 요소들(ECOG PS, Child-Pugh grade, AFP≥400 ng/mL의 비율, extrahepatic disease, macrovascular invasion) 간의 차이도 꽤 있었다.
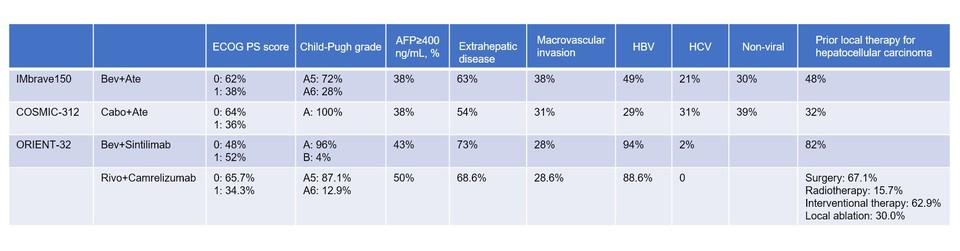
그렇다면, 리보세라닙+캄렐리주맙 병용요법 글로벌 임상 3상에 등록된 환자의 바이러스 병인은 어땠을까? 공개된 데이터가 없기 때문에 지금은 판단 근거가 없다. 다만, 항서제약이 작년 2월 Clinical Cancer Research에 발표한 간세포암 관련 캄렐리주맙+리보세라닙 병용요법 연구3 는 의미 있는 참고 자료가 될 수 있다. 해당 연구는 중국에서만 진행되었고 간세포암 1/2차 치료라인을 모두 포함하였다.
이 연구에서 간세포암 1차 치료 관련 데이터는 경쟁 약물 조합의 1-2상 데이터와 비슷한 수준이었다. 다만, 논문 토론 섹션에서는 AST(aspartate aminotransferase, 간효소) 수치가 상승했다는 점을 언급했다(3-5등급 AST 상승: 10%). 이러한 이유에 대해 구체적으로 명시하지는 않았지만, 임상시험 환자군의 대다수가 HBV 환자(88.6%)인 점을 꼽았다.
그렇다면, 캄렐리주맙+리보세라닙 병용요법의 AST 상승은 경쟁 약물 대비 유의하게 높은 수준인가? 적확한 비교 사례가 있는 것은 아니지만, 이노벤트(Innovent)가 스폰서였고 중국에서만 진행된 베바시주맙+신틸리맙 병용요법(ORIENT-32)4 데이터는 참고할 만하다. 이들도 대부분 HBV 환자만 모집(94%)했는데 해당 연구에서 3-4등급 AST 상승 비율은 3% 미만이었다(ORIENT-32 연구에 등록된 환자들은 경쟁 약물 임상 대비 더 악조건의 환자군을 대상으로 했음). 또한 HBV:HCV 환자 비율이 약 2:1이었던 IMbrave150 연구에서는 3-4등급 AST 상승이 약 7% 정도 확인되었다.
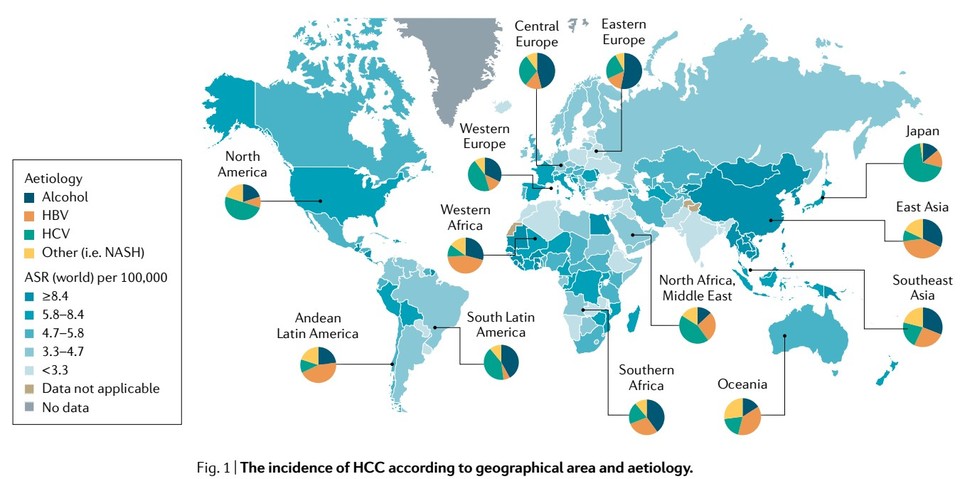
HCC의 발병 원인을 봤을 때, 아시아 환자는 HBV 비율이 높은 편이고 북미와 서유럽은 HCV 비율이 높다. 또한 HBV 환자군의 예후는 상대적으로 좋지 않은 편이다5 . 캄렐리주맙+리보세라닙의 임상 사이트(NCT03764293)는 중국 사이트 비율이 압도적으로 높고 HBV 환자 비율이 꽤 높았을 것으로 추정된다. 보도자료에 부작용 관련 내용은 없기 때문에 향후 발표될 상세 데이터를 통해 간수치 변화 관련 부작용 양상을 살펴봐야 할 것이다.
간세포암 1차 치료 약물로 이미 상용화된 아테졸리주맙+베바시주맙 병용요법은 다양한 글로벌 임상시험을 통해 개별 약물의 프로파일 뿐만 아니라, 병용요법의 프로파일도 알려진 상황이다. 반면, 캄렐리주맙, 리보세라닙의 단독요법, 병용요법 데이터는 대부분 중국 임상 데이터이다. 또한 두 약물은 미국 FDA 승인을 받지 못했다.
이러한 점을 고려하여 항서제약은 임상시험 설계 단계부터 FDA와 충분한 소통을 해왔다고 한다. 더불어 Luzsana의 최고의료책임자인 Joseph E. Eid은 Fierce Pharma와의 인터뷰6 에서 "의료 현장에서는 데이터에 따라 약물의 가치를 판단할 것"이라는 취지의 코멘트를 하였다. 다른 지역보다 빅파마의 헤게모니가 강한 미국 시장에서 우수한 데이터로 경쟁하겠다는 것이다.
면역관문억제제와 혈관신생저해제 병용요법이 간세포암 환자에게 혜택이 있다는 것은 상당부분 알려졌지만, 규명된 것보다는 그렇지 않은 영역이 훨씬 많다. 예컨대, 임상적 혜택이 있는 환자군을 선별할 수 있는 예측 바이오마커는 여전히 부재한 상황이다(PD-L1 발현도와의 상관관계도 유의하지 않음). 따라서 임상 3상을 마친 여러 회사들은 병용요법 혜택을 볼 수 있는 집단을 찾고자 다양한 연구를 지속하고 있다. 항서제약과 에이치엘비에게도 필요한 연구일 것이다.
캄렐리주맙+리보세라닙 병용요법의 차별성과 경쟁력은 의료 학회에서 공개되는 데이터를 통해 정확히 판단할 수 있을 것이다. 이와 함께 지금부터는 데이터 차별성을 넘어 정교한 상업화 전략을 세우고 시장에 알려야 할 것이다. 임상 3상은 상업화로 가기 위한 첫 걸음일 뿐.
[참고] 간세포암에서 항PD-(L)1항체와 혈관신생저해제 병용요법이 유의한 혜택을 주는 근거
항PD-(L)1 항체가 면역관문억제제의 주류가 되면서 이들과 다양한 약물 간의 병용요법을 통해 시너지를 탐색하는 연구는 매우 많았다. 그 중에서 면역관문억제제와 혈관신생저해제 병용요법은 일부 암종에서 유의미한 효능을 보여줬다. 이와 관련된 기전이 아주 명확하게 확립된 것은 아니다. 다만, 항혈관신생 약물이 종양 내피를 변경하여 약물 전달을 개선할 수 있고 이를 통해 효과기 면역 세포(effector immune cells)의 침윤이 증가할 수 있다는 논리7 는 비교적 널리 인용되고 있다.
이러한 논리는 신세포암, 간세포암 임상시험에서 유망한 데이터로 확인되었고 꽤 많은 그룹들이 이 분야에 도전하고 있다. 간세포암의 경우, 베바시주맙과 아테졸리주맙 병용요법이 FDA 승인을 받았지만, 이들 약물 조합이 승인받기 전부터 몇몇 그룹들은 (글로벌) 임상 3상을 시작했었다. 대표적으로 렌바티닙+펨브롤리주맙(Eisai/Merck), 카보잔티닙+아테졸리주맙(Exelixis/Roche), 리보세라닙+캄렐리주맙(HLB/Hengrui) 그리고 베바시주맙(바이오시밀러)+신틸리맙(Innovent) 등을 들 수 있다. 참고로 카보잔티닙+아테졸리주맙(COSMIC-312 연구)는 무진행생존기간의 혜택은 있었지만, 전체생존기간 혜택은 없었고 엑셀리시스는 상업화를 포기했다8 .
참고문헌
(1) Finn RS, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020 May 14;382(20):1894-1905. doi: 10.1056/NEJMoa1915745. PMID: 32402160.
(2) http://static.sse.com.cn/disclosure/listedinfo/announcement/c/new/2022-05-13/600276_20220513_3_d5zRlskq.pdf
(3) https://www.annalsofoncology.org/article/S0923-7534(21)04544-0/fulltext
(4) Xu J, et al. Camrelizumab in Combination with Apatinib in Patients with Advanced Hepatocellular Carcinoma (RESCUE): A Nonrandomized, Open-label, Phase II Trial. Clin Cancer Res. 2021 Feb 15;27(4):1003-1011. doi: 10.1158/1078-0432.CCR-20-2571. Epub 2020 Oct 21. PMID: 33087333.
(5) Ren Z, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study. Lancet Oncol. 2021 Jul;22(7):977-990. doi: 10.1016/S1470-2045(21)00252-7. Epub 2021 Jun 15. Erratum in: Lancet Oncol. 2021 Aug;22(8):e347. PMID: 34143971.
(6) Llovet, J.M., Kelley, R.K., Villanueva, A. et al. Hepatocellular carcinoma. Nat Rev Dis Primers 7, 6 (2021). https://doi.org/10.1038/s41572-020-00240-3
(7) https://www.fiercepharma.com/pharma/startup-no-other-chinas-hengrui-launches-luzsana-big-pharma-veterans-top-and-goal-improve
(8) Llovet, J.M., Castet, F., Heikenwalder, M. et al. Immunotherapies for hepatocellular carcinoma. Nat Rev Clin Oncol 19, 151–172 (2022). https://doi.org/10.1038/s41571-021-00573-2
(9) https://ir.exelixis.com/news-releases/news-release-details/exelixis-announces-final-overall-survival-results-phase-3-cosmic

